3.1. Характерные ошибки (продолжение)
Пример 13. На рис. 13 приведены участки фазовых диаграмм, на которых присутствуют фазы переменного состава TiCy (рис.13a), V2Cy и VCy (рис.13b).
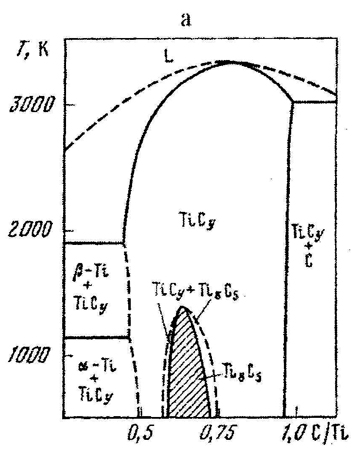
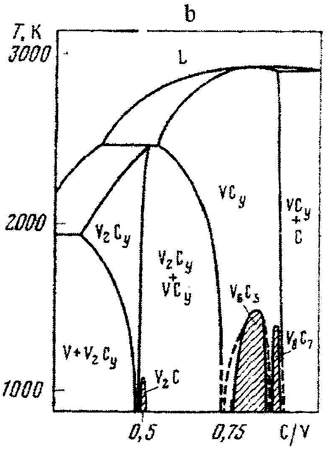
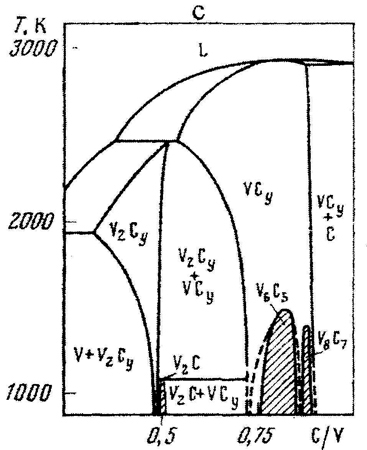
Рис. 13. Т-х фазовые диаграммы состояния участков систем Ti- C (a) и V-C (b) по данным [29] и исправленный вариант для системы V-C (c).
Согласно законам термодинамики понижение температуры ведет к понижению энтропии. В данном случае это проявляется в процессах упорядочения, что приводит к появлению новых фаз с более узкими концентрационными областями гомогенности. Авторы [29] попытались нанести на фазовые диаграммы данные об упорядочении, полученные комплексом физических методов исследования. Это им удалось корректно для системы Ti – C: фаза TiCy при охлаждении выделяет фазу идеализированного состава Ti8C5. На фазовой диаграмме имеются двухфазные области сосуществования этих фаз и только одна точка, в которой составы сосуществующих фаз совпадают, Эта точка конгруэнтного перехода соответствует максимальной температуре существования фазы на основе соединения Ti8C5. За исключением этой точки фазовый переход

осуществляется в температурном и концентрационном интервале, т.к. является моновариантным. Такая картина полностью соответствует правилу фаз и правилу фаз в соприкасающихся областях.
Фаза VCy (рис.13b) при охлаждении выделяет две фазы: на основе соединений V6C5 и V8C7. Фазовые равновесий с участием фаз V6C5 и VCy такого же типа, как и для фаз TiCy и Ti8C5 и на рис.13b обозначены корректно. Что касается фазы V8C7, то на рис. 13b не обозначены двухфазные области V8C7 + VCy, что, по-видимому, связано с недостатком места на чертеже.
Серьезная ошибка допущена при изображении упорядочения фазы V2Cy. При понижении температуры она выделяет упорядоченную почти стехиометрическую фазу V2C. Однако, в отличие от предыдущих случаев, состав низкотемпературной фазы лежит не внутри, а вне области гомогенности высокотемпературной фазы, а именно – в двухфазном поле V2Cy + VCy. В таком случае на фазовой диаграмме должна присутствовать горизонталь трехфазного равновесия
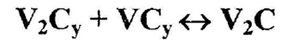
не обозначенная на рис. 13b. Корректная схема фазовых равновесий приведена на рис.13с.
Пример 14. При построении фазовой диаграммы системы из молибдатов таллия и лития (рис. 14а) нарушено правило фаз в соприкасающихся областях состояния. Фаза II примыкает к трехфазной горизонтали в области концентраций, что ведет к изменению числа фаз на 2. Правильным было бы касание однофазной области и трехфазной горизонтали в точке (рис. 14 b). См. также рис. 14с.
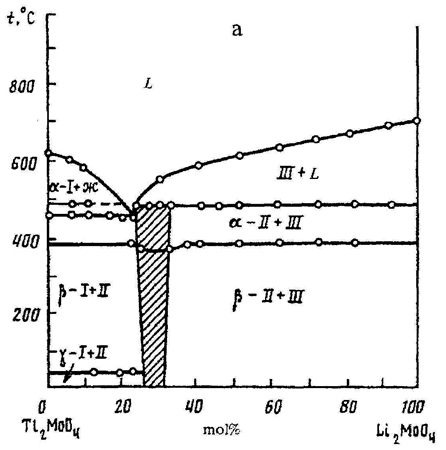
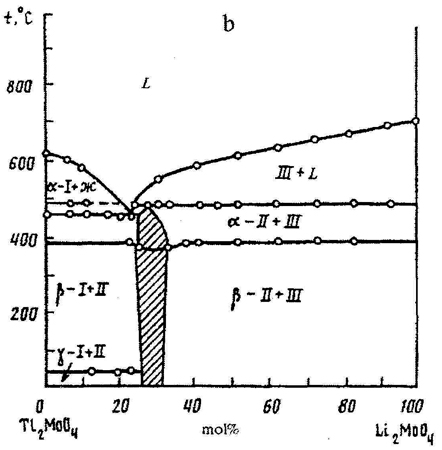
Рис. 14. Т-х фазовая диаграмма состояния системы Lil2MoO4 – Li2MoO4 по данным [30] (а) и исправленный вариант этой диаграммы (b).
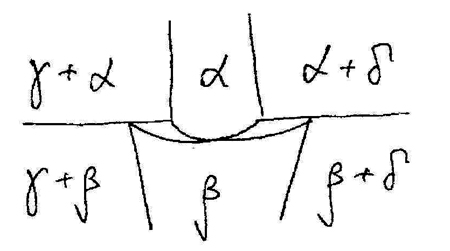
Рис. 14с. Корректная возможная схема полиморфного превращения фазы переменного состава.
Пример 15. На рис. 15а приведена фазовая диаграмма системы Ho-Er с непрерывными твердым и жидким растворами между компонентами. Температура плавления монотонно меняется с концентрацией. Ошибка заключается в том, что не обозначена двухфазная область L + S. Согласно правилу фаз для двухкомпонентных систем (К = 2) двухфазные равновесия (фи = 2) при постоянном давлении (Р = const, a = 1) является моновариантным равновесием (F = 1). Таким образом, в отличие от чистых компонентов, плавление или затвердевание твердого раствора должно происходить в интервале температуры между кривыми ликвидуса и солидуса. Это полностью справедливо и для модели идеальных растворов. Представленная на рис. 15а фазовая диаграмма прямо нарушает также правило фаз в соприкасающихся областях.
В экспериментальном исследовании [31] по-видимому, не придали значения уширению пиков на термограммах, отвечающих плавлению твердого раствора по сравнению с чистыми металлами.
Корректный вариант фазовой диаграммы представлен на рис. 15b.
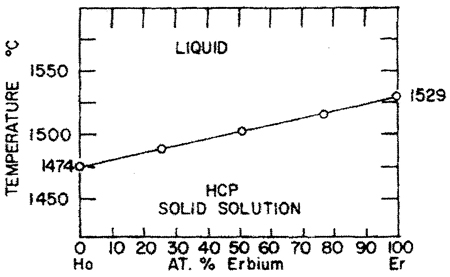
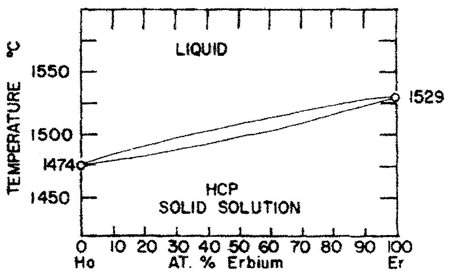
Рис. 15. Т-х фазовая диаграмма системы Ho – Er по данным [31] (а) и корректный вариант этой диаграммы (б). HCP solid solution –твердый раствор со структурой гексагональной плотнейшей упаковки.
Пример 16. Этот пример (рис. 16а) похож на предыдущий. На фазовой диаграмме области двухфазных моновариантных равновесий между твердым растворами и расплавом стянуты в линии, чем нарушается правило фаз и правило фаз в соприкасающихся областях. Кроме того, равновесие трех фаз в средней части системы должно порождать трехфазное нонвариантное равновесие перитектического типа.
Корректный вариант фазовой диаграммы представлен на рис. 16b, см. также рис. 16с.
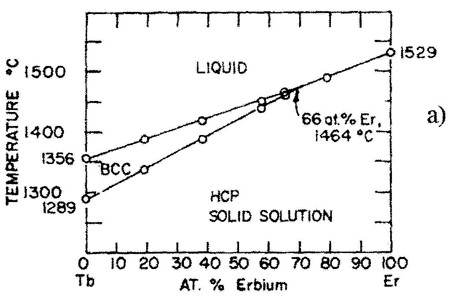
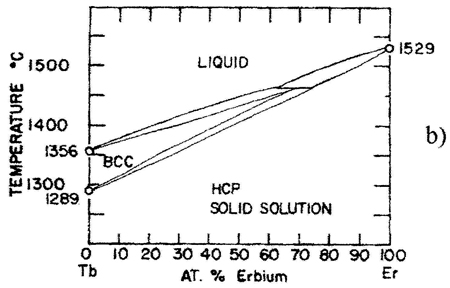
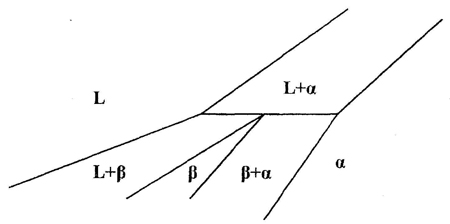
Рис. 16. Т-х фазовая диаграмма системы Tb – Er по данным [31] (а) и корректный вариант этой диаграммы (б) и схема трехфазного равновесия перитектического типа, отвечающая фазовой диаграмме системы Tb-Er (с).
Пример 17. На рис. 17 приведена фазовая диаграмма системы из оксидов циркония и диспрозия по [32]. На кривых плавления тугоплавкого твердого раствора на основе высокотемпературной кубической модификации оксида циркония пунктиром изображены максимумы, но кривые ликвидуса и солидуса не смыкаются в этих точках, что, конечно, является ошибкой. Экспериментальное определение кривой ликвидуса в этой системе, проведенное с использованием солнечной печи [33] показало, что максимум действительно существует. Точка максимума отвечает содержанию 15 мол % оксида диспрозия и температуре 2750 °С. Авторы [32] пытались нарисовать участок фазовой диаграммы при температуре выше 2000°С "так просто, как это возможно в соответствии с правилом фаз", но им это не удалось.
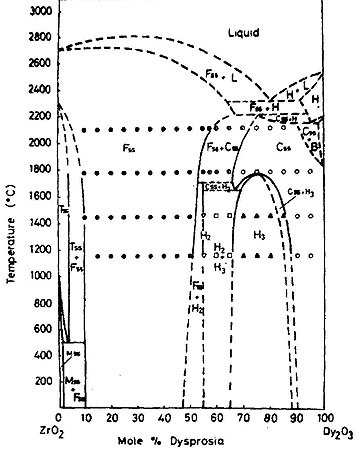
Рис. 17. Т-х фазовая диаграмма системы ZrO2 – Dy2O3 по данным [32] (a) и корректное изображение максимума на кривых плавления твердого раствора (b).
Пример 18. На рис. 18 представлена фазовая диаграмма системы из сульфида и арсенида мышьяка по [34] с непрерывными жидким и твердым растворами между компонентами, имеющими близкие температуры плавления. Данные дифференциального термического анализа интерпретированы неаккуратно, вследствие чего на фазовой диаграмме изображены одновременно максимум на кривой ликвидуса и минимум на кривой солидуса. Некорректность такого построения (как и в примере 17) можно проверить, например, методом, изложенным в [2]. Если в двухфазной области "твердое + жидкое" мы проведем коноды, то при температурах, превышающих температуру плавления AsS, мы получим равновесие двух жидких фаз; при температурах ниже температуры плавления AsSe мы получим равновесие двух твердых фаз. Однако, расслаивания ни в жидком, ни в твердом состоянии в этой системе не отмечено [34].
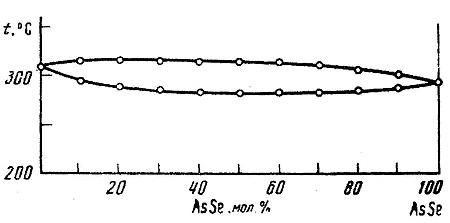
Рис. 18. Т-х фазовая диаграмма системы AsS – AsSe по данным [34].
Пример 19. На рис. 19 изображен набросок части диаграммы состояния системы KF – BiF3 по [35]. На кривых плавления гексагональной фазы вблизи BiF3 имеется максимум. Некорректно то, что кривая солидуса изображена состоящей из двух ветвей, пересекающейся в точке максимума с кривой ликвидуса: эти кривые в точке максимума должны иметь общую горизонтальную касательную. Что касается флюоритовой фазы переменного состава в средней части системы, то изображено боковое касание кривых ликвидуса и солидуса, причем последняя изображена в виде двух ветвей, пересекающихся в точке касания. Это также противоречит следствию из уравнения Ван-дер-Ваальса (1), см, раздел 2.2. Корректный вариант диаграммы состояния этой системы приведен в [36].
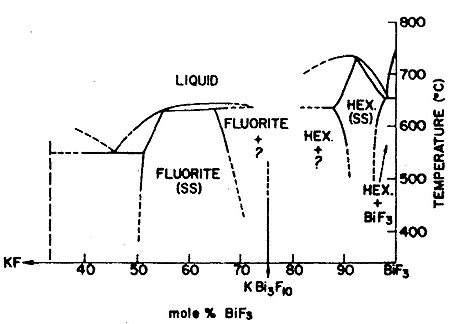
Рис. 19. Т-х фазовая диаграмма системы KF – BiF3 по данным [35].
Пример 20. По данным, полученным методом визуально- термического анализа (на рис. 20 показаны кружками) в системе из йодидов кадмия и ртути предполагается [37] существование непрерывного твердого раствора между йодидом кадмия и высокотемпературной модификацией йодида ртути. Однако, эти компоненты не изоструктурны. Иодид кадмия кристаллизуется в тригональной сингонии, высокотемпературная желтая модификация йодида ртути - в ромбической, а низкотемпературная красная - в тетрагональной, и, соответственно, не могут образовывать непрерывные твердые растворы. Предполагаемая схема фазовых равновесий в этой системе нанесена на рис. 20 пунктиром.
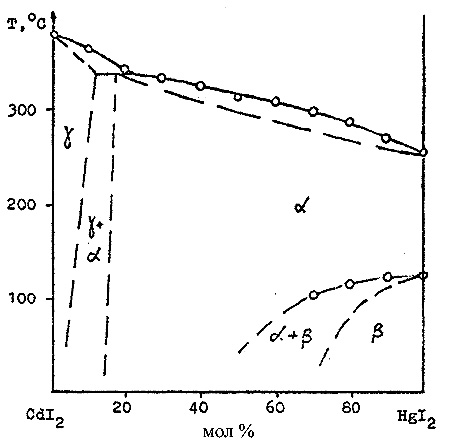
Рис. 20. Т-х фазовая диаграмма системы CdI2 – HgI2.
Пример 21. На рис. 21 представлена схема фазовых переходов в твердых растворах дисульфида и диселенида никеля [38]. На этой диаграмме однофазные области с различной кристаллографической симметрией непосредственно граничат друг с другом в интервале температур, хотя по крайней мере некоторые фазовые переходы между ними относятся к переходам первого рода. При этом нарушается правило фаз в соприкасающихся областях состояния, так как число фаз при переходе из области в область меняется на два (одна фаза исчезает и новая появляется). Такие неточности типичны в физической литературе, посвященной изучению фазовых переходов в бинарных системах. Кроме того, на диаграмме область твердых растворов доходит до 0 К, что противоречит третьему началу термодинамики.
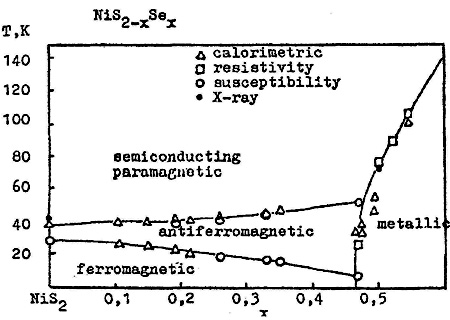
Рис. 21. Т-х фазовая диаграмма системы NiS2 – NiSe2 по данным [38].
Пример 22. Ошибки, допущенные при построении фазовой диаграммы Sm-Gd (рис. 22а), аналогичны тем, которые разобраны в примерах 15, 16, 21: области двухфазных моновариантных равновесий (расплав и высокотемпературный твердый раствор; высокотемпературный и низкотемпературный твердые растворы) стянуты в линии, чем нарушается правило фаз и правило фаз в соприкасающихся областях. Кроме того, некорректно построены низкотемпературные фазовые равновесия, обозначенные пунктиром на фазовой диаграмме. На рис. 22а границы областей гомогенности твердых растворов стремятся к вертикальным касательным. Это означает, что при абсолютном нуле температуры должны сохраняться значительные области твердых растворов, что противоречит третьему закону термодинамики.
Корректный вариант фазовой диаграммы представлен на рис. 22b. Необходимым следствием третьего закона термодинамики в данном случае является ретроградная растворимость одного компонента в другом, а именно Gd в альфа Sm.
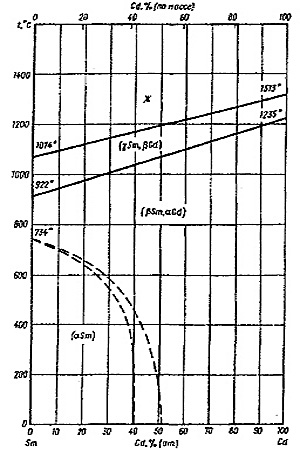
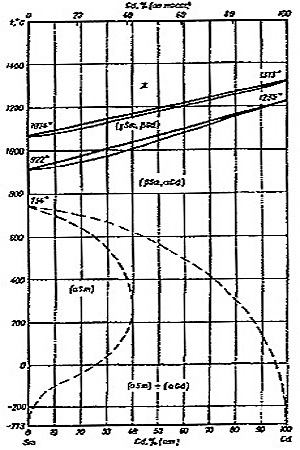
Рис. 22. Т-х фазовая диаграмма системы Sm -Gd по [18] (a) и корректный вариант этой диаграммы (b).
Пример 23. На рис. 23а представлен фрагмент фазовой диаграммы системы CaO-P2O5 по [39, 40]. В системе существует соединение CaO•P2O5, имеющее полиморфный переход, и твердые растворы на основе обеих модификаций. Кроме того, на фазовой диаграмме присутствует фаза трёмелит переменного состава, плавящаяся по перитектической реакции. Эвтектическая горизонталь О-Н соответствует равновесию расплава, твердого раствора на основе альфа CaO•P2O5 и трёмелита. На рис. 23а нарушено правило Холлмана [11], а именно: продолжения отрезков O-O’ и W-Z уходят в однофазные области - твердого раствора на основе альфа CaO•P2O5 и трёмелита, соответственно. Термодинамически корректным было бы продолжение этих отрезков в двухфазные области. На рис. 23б и 23в показаны варианты корректного и некорректного построения пересекающихся кривых ликвидуса. Фазовая диаграмма, соответствующая варианту 23в, приведена в работе [41] для системы NaMgPO4- NaCaPO4, в которой образуется соединение 1:1, плавящееся по перитектической реакции.
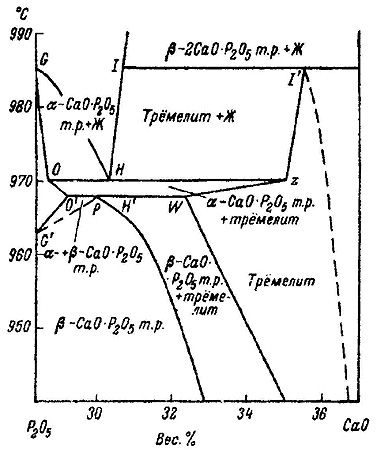
Рис. 23а. Участок Т-х фазовой диаграммы системы P2O5-CaO по данным [39,40] .
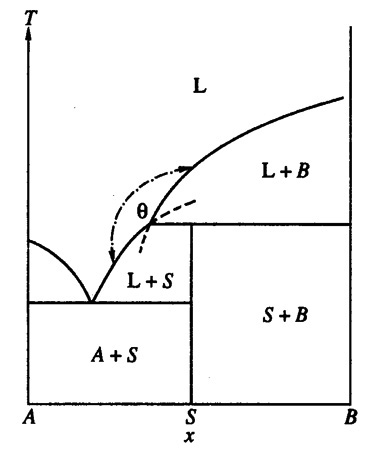
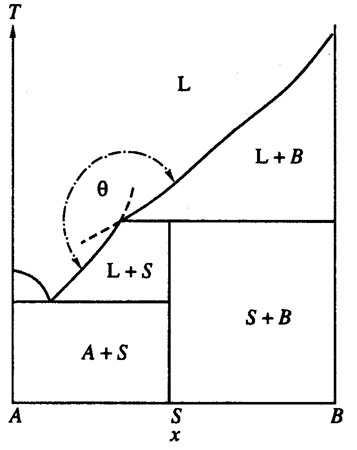
Рис. 23 б, в. Т-х фазовые диаграммы бинарных систем с правильным (б, тэта < 180°) и неправильным (в, тэта < 180°) продолжением линий двухфазных равновесий [12] .
