3. Характерные ошибки
Ниже приводится ряд ошибочных диаграмм состояния, в основном двойных солевых систем. Часть из них содержит ошибки, связанные с несоблюдением термодинамических положений, перечисленных в предыдущем разделе. Некоторые из них согласуются с этими положениями, но тем не менее являются ошибочными, противоречащими, например, кристаллохимическим данным. В некоторых случаях ошибочность диаграммы может быть выявлена только при более детальном изучении с использованием более совершенных (мощных) методов исследования.
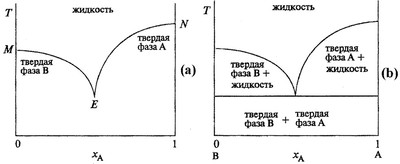
Пример 1, приведенный на рис.1а, в комментариях не нуждается. Отметим, что он взят из книги [15], изданной в серии «Лучший зарубежный учебник».
Рис. 1. Т-х фазовая диаграмма двухкомпонентной системы эвтектического типа по [15] (a) и корректный вариант фазовой диаграммы (b).
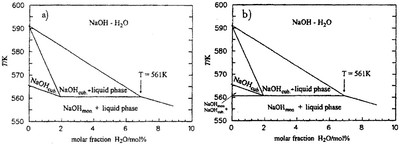
Пример 2. На фрагменте фазовой диаграммы системы NaOH-H2O по данным [16], см. рис. 2а, представлены фазовые равновесия с участием трех фаз: жидкости L, твердого раствора на основе высокотемпературной кубической модификации NaOH и низкотемпературной моноклинной модификации NaOH (твердый раствор на основе этой модификации имеет пренебрежимо малую ширину). При 561 К имеет место трехфазное равновесие (уравнение 4)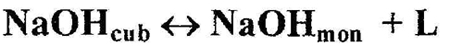
Ошибка, имеющая место на рис. 2а, заключается в том, что горизонталь трехфазного равновесия не доведена до ординаты NaOH . Пропущено двухфазное поле NaOHcub + NaOHmon. Ошибка исправлена на рис. 2b.
Рис. 2. Т-х фазовая диаграмма системы NaOH-H2O по [16] (a) и корректный вариант фазовой диаграммы (b).
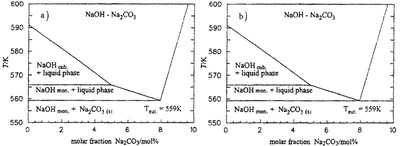
Пример 3. Ошибка, допущенная на рис. 3а, аналогична предыдущей: горизонталь, отвечающая трехфазному эвтетктическому равновесию (уравнение 5)
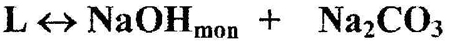
Рис. 3. Т-х фазовая диаграмма системы NaOH-Na2CO3 по [16] (a) и корректный вариант фазовой диаграммы (b).
Пример 4. На фазовой диаграмме, изображенной на рис.4а, имеет место расслаивание в расплаве, которое накладывается на линию первичной кристаллизации (ликвидуса) твердого раствора на основе TiO2. Трехфазная горизонталь монотектического равновесия (уравнение 6)
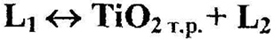
должна доходить до состава твердой фазы, участвующей в равновесии.
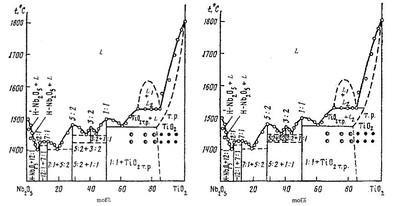 Рис. 4. Т-х фазовая диаграмма системы Nb2O5 –TiO2 по [17] (a) и корректный вариант фазовой диаграммы (b).
Рис. 4. Т-х фазовая диаграмма системы Nb2O5 –TiO2 по [17] (a) и корректный вариант фазовой диаграммы (b).
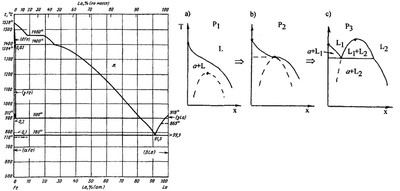
Пример 5. На фазовой диаграмме системы Fe-La, приведенной на рис.5, имеется аномалия на кривой ликвидуса сигма-Fe в виде горизонтального отрезка при 1460 °С. Такой ход ликвидуса невозможен: горизонтальный отрезок на Т-х фазовой диаграмме бинарных систем отвечает равновесию двух фаз, составы которых задаются концами отрезка. Таким образом, этот рисунок говорит о наличии двух жидких фаз разного состава Ж1 и Ж2, т.е. о расслаивании в жидкости. В таком случае должно иметь место монотектическое равновесие (уравнение 7)
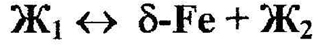
с трехфазной горизонталью, доходящей до дельта-Fe-фазы, т.е. практически до ординаты железа. Кроме того, на диаграмме должен присутствовать купол расслаивания жидкости выше 1460 °С. Если расслаивание жидкости в этой системе не имеет места, ход кривой ликвидуса на рис. 5.1 утрирован.
Рис. 5.1. Т-х фазовая диаграмма системы Fe – La по [18].
Рис. 5.2. Возможная последовательность фазовых равновесий при изменении давления Р. Пунктир - метастабильные равновесия, отвечающие расслаиванию переохлажденного расплава.На рис. 5.2 представлена последовательность фазовых равновесий, отвечающих изменению топологии фазовой диаграммы (бифуркации, см. [13]) за счет повышении температуры верхней критической точки купола расслаивания расплава. На рис. 5.2a и 5.2b на кривой ликвидуса имеется точка перегиба, причем для случая 5.2b (точка бифуркации) имеет место совпадение верхней точки купола расслаивания с кривой ликвидуса; касательная к кривой ликвидуса в этой точке (точке перегиба) горизонтальна.
Таким образом, на кривых ликвидуса на фазовых диаграммах бинарных систем могут иметь место достаточно сильные аномалии, но образование горизонтальных участков без появления новых фаз исключено. Кроме того, на кривых ликвидуса невозможно и наличие изломов без фазовых переходов в сосуществующих фазах, т.к. излом указывает на разрыв на концентрационной зависимости свободной энергии.
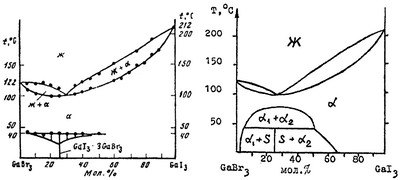
Пример 6. На фазовой диаграмме системы из бромида и йодида галлия по данным [19], рис.6а, изображена изотермическая горизонталь в твердом состоянии, обозначающая верхнюю границу устойчивости промежуточного соединения. Однако, не показаны составы двух фаз, равновесие которых с образующимися в системе соединением может давать нонвариантное трехфазное равновесие. К горизонтали сверху должна примыкать двухфазная область, отсутствующая на диаграмме. Возможный вариант фазовых равновесий, устраняющих эту ошибку, приведен на рис. 6b.
Рис. 6. Т-х фазовая диаграмма системы GaBr3 – GaI3 по данным [19] (а) и возможный корректный вариант этой диаграммы (б).
Кроме того, имеется ошибка построения, заключающаяся в том, что кривая ликвидуса состоит из двух пересекающихся ветвей, которые пересекаются с кривой солидуса, причем не в точке минимума. Корректным является смыкание кривых ликвидуса и солидуса в точке минимума при наличии общей горизонтальной касательной.
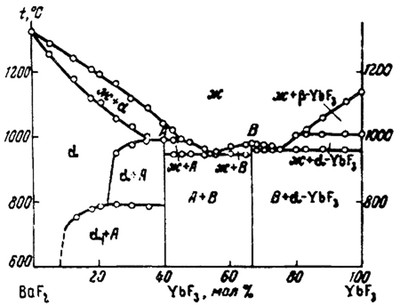
Пример 7. Фазовая диаграмма системы из фторидов бария и иттербия по данным [20] построена (рис. 7) с явным нарушением правила фаз, так как горизонталь в твердом состоянии при ~ 800 °С, которая должна отвечать трехфазному равновесию, "повисает в воздухе": не изображена третья фаза, которая должна соприкасаться с такой горизонталью.
Рис. 7. Т-х диаграмма системы BaF2 – YbF3 по данным [20].
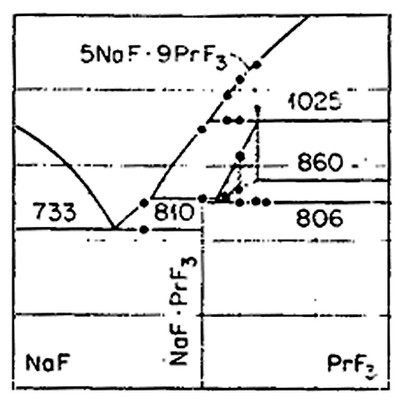
Пример 8. Этот пример (рис. 8) аналогичен предыдущему. На фазовой диаграмме системы из фторидов натрия и празеодима по данным [21] обозначена горизонталь при 860 °С, которая не имеет физического смысла, т.к. проведена в двухфазной области.
Рис. 8. Т-х фазовые диаграммы системы NaF – PrF3 по данным [21]
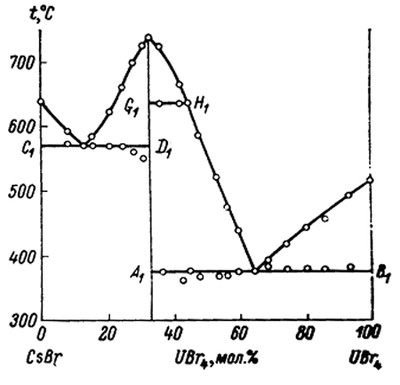
Пример 9. На рис. 9 представлена фазовая диаграмма системы тетрабромид урана - бромид цезия по данным [22]. Горизонталь G1 – Н1, по мнению авторов, отвечает полиморфному превращению соединения 2:1. Однако, в этом случае должно иметься ее продолжение в область с большей концентрацией бромида цезия, что на представленной диаграмме отсутствует.
Рис. 9. Т-х фазовые диаграммы системы CsBr – UBr4 по данным [22]
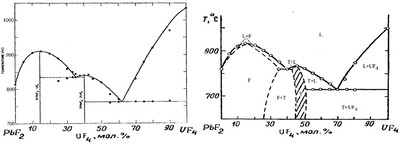
Пример 10. На рис. 10а представлена фазовая диаграмма системы фторид свинца - тетрафторид урана, по данным [23]. Максимум на кривой ликвидуса при ~ 15 мол.% фторида урана приписан конгруэнтному плавлению соединения с отношением компонентов 6:1. Однако, при такой трактовке системы на диаграмме должна присутствовать горизонталь, отвечающая эвтектическому равновесию расплава с фторидом свинца и соединением 6:1, которая экспериментально не наблюдается. Повторное исследование системы [24] показало, в соответствии с предсказанием [25], что в этой системе существует максимум на кривой плавления твердого раствора на основе фторида свинца (рис. 10b). В средней части системы образуется фаза переменного состава со структурой типа LaF3 (тисонита), отвечающая соединению PbUF6, которое может содержать некоторое избыточное количество фторида свинца по отношению к стехиометрии. Точка максимума на кривых плавления этой фазы смещена в сторону PbF2. В работе [23] этой фазе произвольно приписан состав 3PbF2·2UF4.
Рис. 10. Т-х фазовые диаграммы системы PbF2 – UF4 по данным [23] (a) и по данным [24] (b). F –твердый раствор Pb1-xUxF2+2x , Т- фаза переменного состава со структурой тисонита (LaF3).
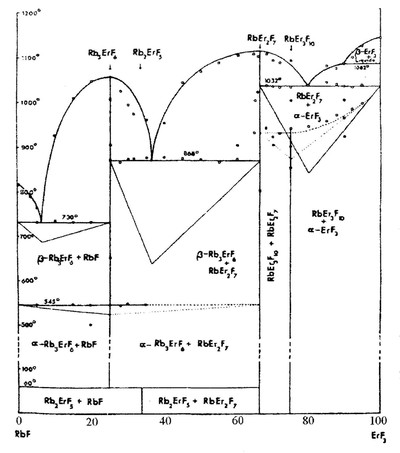
Пример 11. На фазовой диаграмме системы RbF - ErF3 (рис. 11) по [26] твердофазный распад соединения RbEr3F10 на RbEr2F7 и ЕгF3 изображается криволинейной линией, а не горизонталью, как должно быть в соответствии с правилом фаз.
Причина может заключаться в частичном изменении химического состава и увеличении числа компонентов вследствие пирогидролиза образцов, т.к. фторид рубидия очень гигроскопичен, а фторид эрбия при нагревании взаимодействует с парами воды. При этом система из двойной становится тройной взаимной: Rb, Er//O, F. Косвенным признаком пирогидролиза является заниженная температура полиморфного перехода ErF3, которая чувствительна к примеси кислорода [27].
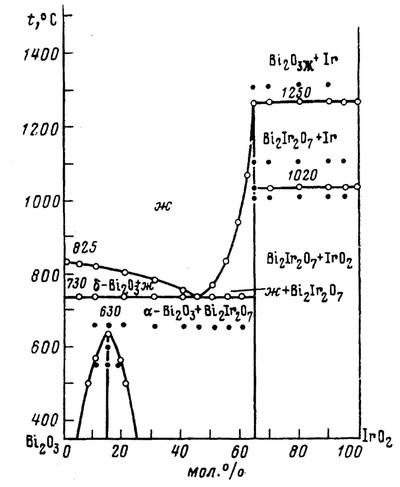
Рис. 12. Т-х фазовая диаграмма состояния системы Bi2O3 – IrO2 по данным [28]. Кружки – данные ДТА. Точки – координаты отожженных образцов.
При нагревании диоксид иридия разлагается до металла, так что рассматриваемая диаграмма явно представляет собой политермический разрез системы Bi–Ir-O, и трактовать ее как бинарную систему некорректно. Ошибка заключается в изображении равновесий с участием соединения 6Bi2O3· IrО2. Распад его в твердом состоянии при 630 °С на Bi2O3 и Bi2Ir2O7 отвечает равновесию трех фаз, чему должна соответствовать горизонталь на Т-х фазовой диаграмме, а не куполообразная кривая.