6. Дополнительные примеры
Пример 35. Этот пример полностью аналогичен примеру 4. На фазовой диаграмме системы SnF2-SnS горизонталь монотектического равновесия не доведена до ординаты соединения SnS, см. рис.35.
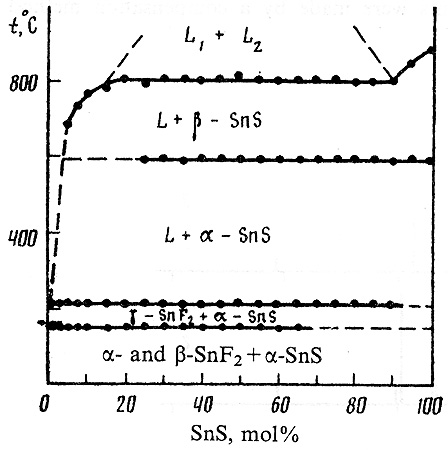
Рис. 35. Фазовая диаграмма системы SnF2-SnS по данным [60].
Пример 36. На рис. 36 представлен фрагмент фазовой диаграммы системы из оксидов натрия и кремния. На основе высокотемпературной модификации соединения 3:2 имеется область гомогенности (твердый раствор). Ошибка заключается в том, что поле твердого раствора граничит с полем расплава по отрезку кривой, соответствующему смыканию ликвидуса и солидуса. Термодинамически корректным является смыкание кривых ликвидуса и солидуса в одной точке с максимальной температурой плавления. Кроме того, поле высокотемпературной модификации примыкает к трехфазной горизонтали полиморфного превращения на отрезке, а не в точке.
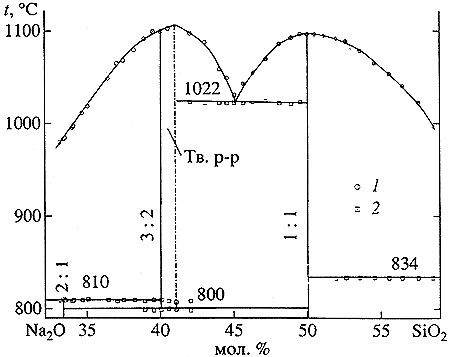
Рис. 36. Фазовая диаграмма системы Na2O-SiO2 в интервале концентрации 33-58,5 мол.% SiO2. Данные, полученные с помощью методов РФА (1) и термического анализа (2) [61].
Пример 37. Этот пример аналогичен примеру 19. Фаза переменного состава II на рис. 37 имеет боковое касание в точке с полем расплава. Корректным должно быть касание кривых ликвидуса и солидуса в точке максимума.
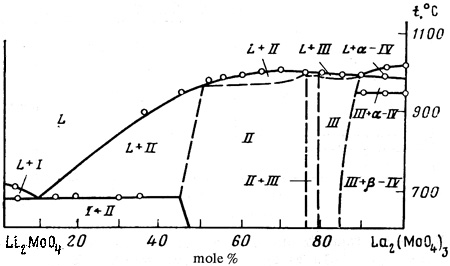
Рис. 37. Фазовая диаграмма системы Li2MoO4-La2(MoO4)3 по [62].
Пример 38. На рис. 38а представлен фрагмент фазовой диаграммы системы Bi2O3-MgO. Выявлена область фазы переменного состава, изменяющегося от соотношения 25:1 до 6:1. Фаза плавится по перитектической реакции при 785 С. Ошибка заключается в том, что поле фазы переменного состава примыкает к трехфазной горизонтали в интервале концентраций приблизительно 9-14 мол.%. При постоянном давлении трехфазное равновесие в бинарной системе нонвариантно, поэтому составы фаз, участвующих в нем, фиксированы. На рис. 38б представлена корректная интерпретация перитектического плавления аналогичной фазы в системе Bi2O3-CuO. Правильность построения этих диаграмм в работе [63] нами не рассматривается.
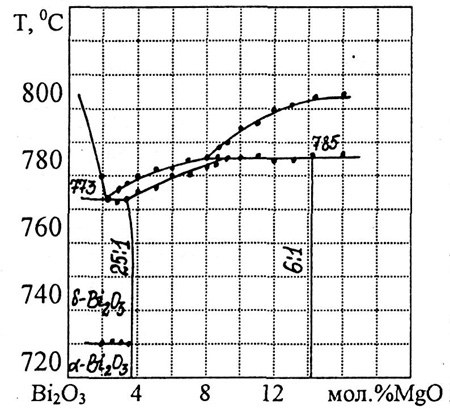
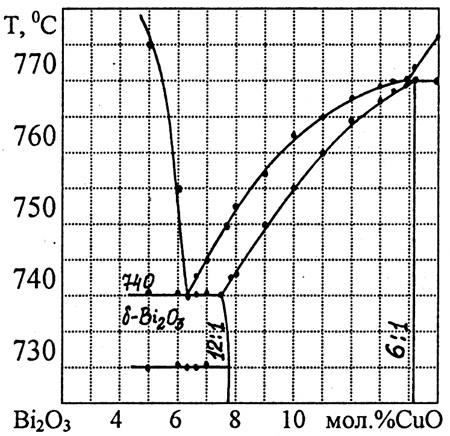
Рис. 38. Участки фазовых диаграмм систем Bi2O3-MgO (a) и Bi2O3-CuO (б) по данным [63].
Пример 39. На рис. 39 представлены фазовые равновесия по разрезу SiO2-LiGaSiO4 по данным [64]. В средней части образуется фаза переменного состава со структурой сподумена. Разрез интерпретирован как нестабильный, соответствующий политермическому разрезу тройной системы. Разрез построен некорректно, в частности, однофазное поле сподумена граничит по линии с трехфазным полем: сподумен+LiGa5O8+расплав.
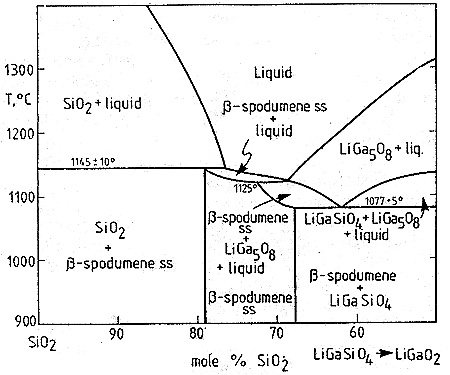 Рис. 39. Фазовая диаграмма по разрезу SiO2-LiGaSiO4 по данным [64].
Рис. 39. Фазовая диаграмма по разрезу SiO2-LiGaSiO4 по данным [64].
Пример 40. На рис. 40 представлены фазовые равновесия в системе из молибдатов рубидия и неодима [65].
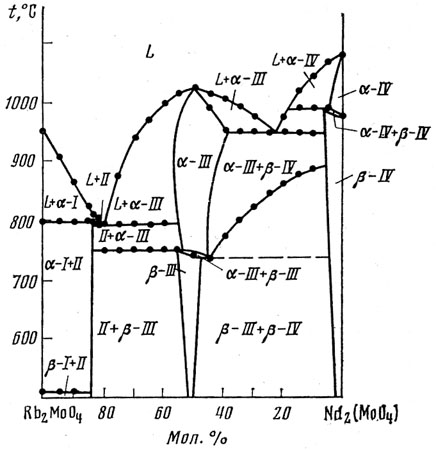 Рис. 40. Фазовая диаграмма системы Rb2MoO4-Nd2(MoO4)3. I - Rb2MoO4; II - Rb5Nd(MoO4)4; III - RbNd(MoO4)2; IV - Nd2(MoO4)3.
Рис. 40. Фазовая диаграмма системы Rb2MoO4-Nd2(MoO4)3. I - Rb2MoO4; II - Rb5Nd(MoO4)4; III - RbNd(MoO4)2; IV - Nd2(MoO4)3.
На рисунке присутствует трехфазное эвтектоидное равновесие альфа III <=> бета III + бета IV при температуре около 720 C. Такое равновесие должно изображаться горизонталью, которая и проведена пунктиром. Однако, экспериментальные точки легли на кривую, проходящую в широком интервале температур ~750-900 С. Это некорректно, соответствующие точки не интерпретированы. По-видимому, при проведении эксперимента равновесие не было достигнуто.
Пример 41. На рисунке 41а приведена фазовая диаграмма системы Та – С по [66]. Этот пример аналогичен примеру 14. Фаза
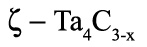 существующая в температурном интервале, примыкает к горизонталям 1430 и 2440 К в концентрационном интервале. Это некорректно. Трехфазное равновесие, например
существующая в температурном интервале, примыкает к горизонталям 1430 и 2440 К в концентрационном интервале. Это некорректно. Трехфазное равновесие, например
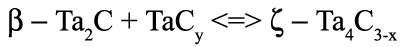 при 2440 К. является нонвариантным. Это означает, что составы фаз, участвующих в равновесии, строго фиксированы. Вариант фазовой диаграммы с корректным изображением этого трехфазного равновесия представлен на рис 41б.
при 2440 К. является нонвариантным. Это означает, что составы фаз, участвующих в равновесии, строго фиксированы. Вариант фазовой диаграммы с корректным изображением этого трехфазного равновесия представлен на рис 41б.
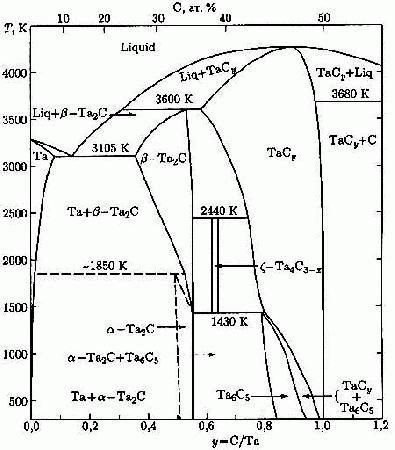
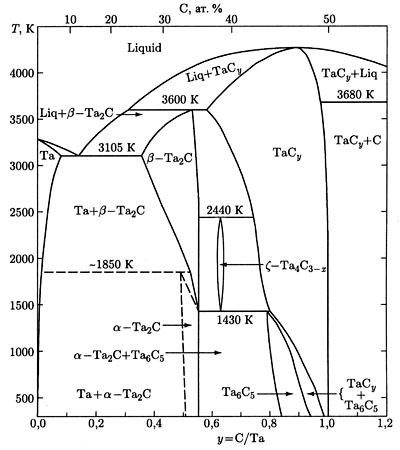 Рис. 41 (а, б).
Рис. 41 (а, б).
Что касается равновесия при 1430 К, то на рис.41a в нем участвуют четыре фазы:
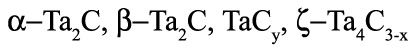 Во-первых, необходимо исправление отрезка касания поля
Во-первых, необходимо исправление отрезка касания поля
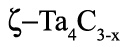 на точку касания, см. рис.41б. Кроме того, в бинарной системе при постоянном давлении четырехфазное равновесие соответствует числу степеней свободы -1. Как показано в разделе 4, такое равновесие может встречаться в качестве исключения в окрестности некоторого строго фиксированного давления. Однако, поскольку в [66] точно таким же образом интерпретированы равновесия в системе Nb-C с участием фазы
на точку касания, см. рис.41б. Кроме того, в бинарной системе при постоянном давлении четырехфазное равновесие соответствует числу степеней свободы -1. Как показано в разделе 4, такое равновесие может встречаться в качестве исключения в окрестности некоторого строго фиксированного давления. Однако, поскольку в [66] точно таким же образом интерпретированы равновесия в системе Nb-C с участием фазы
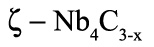 то двойное совпадение является невероятным. В этих случаях корректный вариант фазовых диаграмм требует раздвоения горизонтали на две, соответствующие двум трехфазным равновесиям.
то двойное совпадение является невероятным. В этих случаях корректный вариант фазовых диаграмм требует раздвоения горизонтали на две, соответствующие двум трехфазным равновесиям.
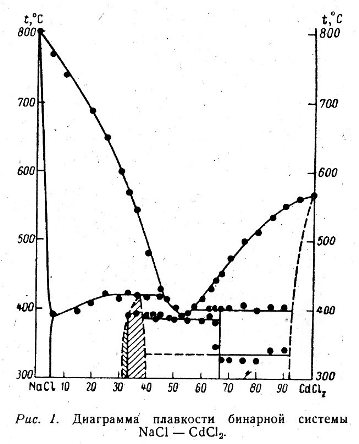
Пример 42. На рис. 42 из работы [67] приведена фазовая диаграмма системы NaCl-CdCl2. Из многочисленных несообразностей этой фазовой диаграммы отметим, что линия, отвечающая перитектическому плавлению фазы с содержанием около 35% CdCl2, должна быть горизонтальным отрезком, поскольку этот процесс - нонвариантный.
Пример 43. На рис.43а представлена картинка из работы [68]. Она не нуждается в особых комментариях. Остается только поражаться воинствующей безграмотности и апломбу авторов и политике редакционной коллегии журнала.
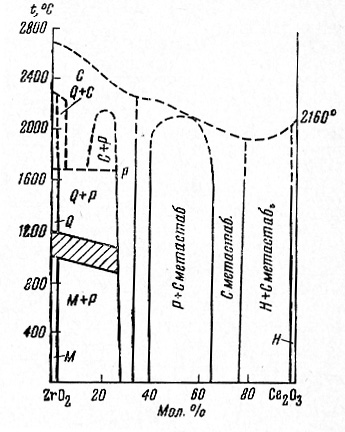 Рис. 43а.
Рис. 43а.
На рисунке 43b представлена корректная фазовая диаграмма этой системы по [90]. Необходимо заметить, однако, что, по-видимому, на равновесной фазовой диаграмме область гомогенности фазы Р должна стягиваться к стехиометрическому составу 50 мол% уже около 1000 С.
Рис. 43б
Пример 44. В работе [69] получены великолепные экспериментальные данные по низкотемпературному упорядочению твердого раствора карбонатов натрия и калия. Область гомогенности упорядоченной нестехиометрической фазы уменьшается с понижением температуры. Однако, фазовые поля в этой работе (см. рис. 44а)
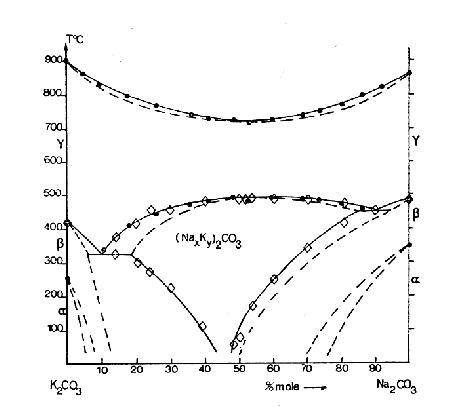 не учитывают требований третьего закона термодинамики. Скорректированный вариант фазовой диаграммы представлен на рис. 44b.
не учитывают требований третьего закона термодинамики. Скорректированный вариант фазовой диаграммы представлен на рис. 44b.
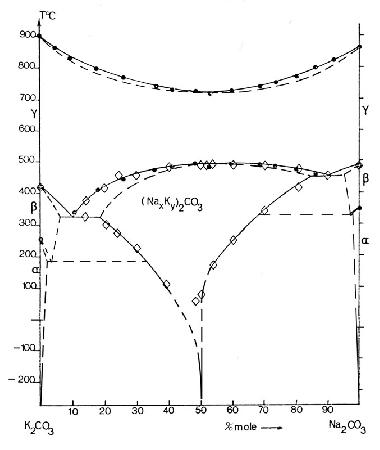
Пример 45. В работе [70] представлена неграмотная версия фазовой диаграммы системы GdF3-YF3 (рис.45а).
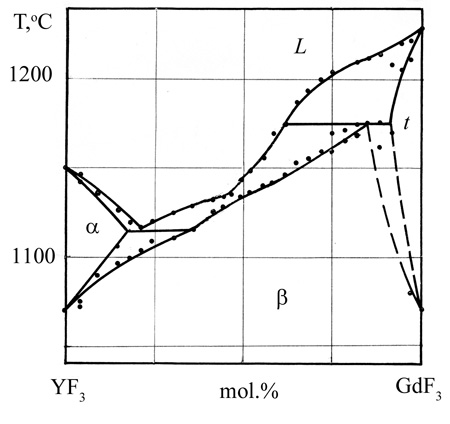
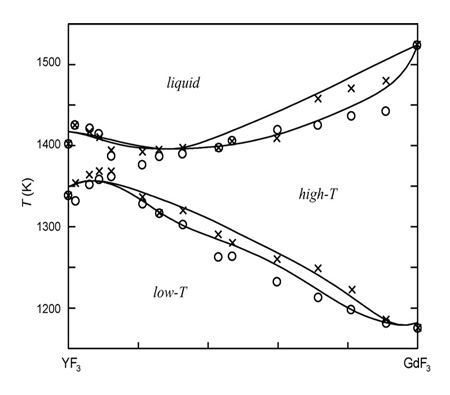 Авторы обозначили непрерывные твердые растворы не только между изоструктурными низкотемпературными модификациями, но и между высокотемпературными модификациями, имеющими разную кристаллическую структуру. Корректная фазовая диаграмма была опубликована ранее [71], см. рис. 45b. Кроме того, авторы [70] использовали грязный фторид гадолиния.
Авторы обозначили непрерывные твердые растворы не только между изоструктурными низкотемпературными модификациями, но и между высокотемпературными модификациями, имеющими разную кристаллическую структуру. Корректная фазовая диаграмма была опубликована ранее [71], см. рис. 45b. Кроме того, авторы [70] использовали грязный фторид гадолиния.
 D. Klimm, I. M. Ranieri, R. Bertram, and S. L. Baldochi have presented a version of the YF3 - GdF3 phase diagram in their paper [70] (Fig. 45a). In this work they designate three distinct areas of: (a) complete liquid miscibility (b) continuous low-temperature orthorhombic solid solution and (c) continuous high-temperature trigonal or hexagonal solid solution.
D. Klimm, I. M. Ranieri, R. Bertram, and S. L. Baldochi have presented a version of the YF3 - GdF3 phase diagram in their paper [70] (Fig. 45a). In this work they designate three distinct areas of: (a) complete liquid miscibility (b) continuous low-temperature orthorhombic solid solution and (c) continuous high-temperature trigonal or hexagonal solid solution.
Unfortunately, this diagram is incorrect.
First, the crystal structures of high-temperature alpha-YF3 and alpha - GdF3 polymorphic modifications are different. Authors [70] did not take it into account. Instead, they considered that if system components belonged to the same type of the crystal system they can form continuous solid solution. It is not correct, for the components should be of the same structure in order to do so. In other words, having the same type of the crystal lattices is a necessary condition, but it is not a sufficient one. High-temperature alpha-GdF3 belongs to the tysonite structural type, having the same structure as LaF3. Different space symmetry groups (P-3c1, Z = 6 and P63/mmc, Z = 2) for tysonites have been explained in [81, 82] by their impurity or polysynthetic twinning. In contrast, crystal structure of alpha-YF3, determined by the high-temperature X-ray diffraction, is similar to the one of alpha-UO3 [83], or anti- Li3N [84].
At the same time, low-temperature modification of betta-GdF3 is isostructural to betta-YF3 (orthorhombic lattice, Pnma space symmetry group). As a result, a continuous solid solution could be formed for the low-temperature betta-modification, but its formation for the high-temperature alpha-YF3 and alpha-GdF3 is impossible. One can observe only limited solubility for alpha-YF3 – alpha-GdF3 solid solutions.
The second problem, missed by authors [70], concerns alpha - GdF3 -- betta - GdF3 polymorphous transformation.
Thoma [85] and Spedding [86] reported in their earlier papers dramatically different temperatures (900 and 1077oC, respectively) for the above phase transition. This contradiction was explained later by Sobolev et al. [27, 87], that this difference was a result of oxygen contamination. The oxygen admixture dissolves primarily in the high-temperature alpha- GdF3 modification, thus expanding the area of the existence of tysonite-type phase as well as superficial low-temperature polymorphism. In the reality, the temperature effect at 900oC, observed by many authors, corresponds to the eutectic alpha - GdF3 -- betta - GdF3 + GdOF three-phase equilibrium, where alpha and betta are high- and low-temperature modifications of GdF3 [88].
When the authors [70] converted rare earth element oxides to fluorides with hydrogen fluoride, they skipped a crucial step; they did not melt the product under a fluorinating atmosphere [89, 71]. The latter procedure decreases oxygen contamination down to a few hundredths of wt. % [27]. Whereas the authors [70] did not determine the exact oxygen content in their specimen, comparison of “GdF3” thermogram from [70] and GdF3 - Gd2O3 phase diagram data [27] indicates that authors’ [70] sample(s) had about 1 mol. % Gd2O3. This amount of oxide impurity was sufficient to change the temperature of the observed polymorphous transformation of GdF3 by dozens degrees (oC).
The YF3 - GdF3 phase diagram was previously studied, along with many other RF3- R’F3 systems (R and R’ – rare earth elements) [89, 71] (Fig. 45b).
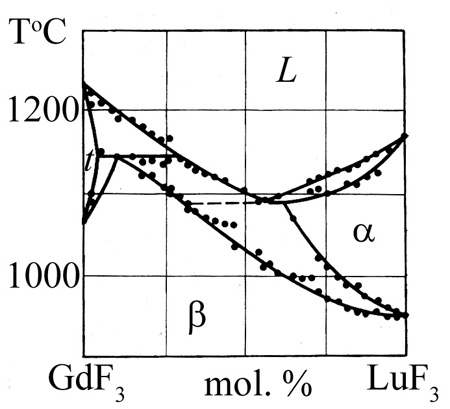
Пример 46. Те же авторы [73] опубликовали неверную фазовую диаграмму системы GdF3-LuF3 (рис. 46а).
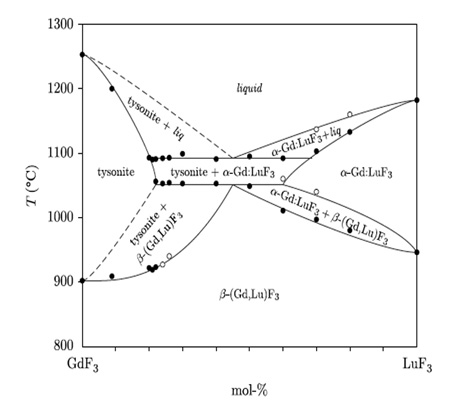 Корректная версия опубликована ранее [71] (рис. 46b). Критичным оказалось содержание около 1 мол.% оксида в использованном фториде гадолиния.
Корректная версия опубликована ранее [71] (рис. 46b). Критичным оказалось содержание около 1 мол.% оксида в использованном фториде гадолиния.
Пример 47. На рисунке 47 приведена широко известная и приводимая во всех справочниках фазовая диаграмма. Красная линия примерно отделяет высокотемпературную часть диаграммы, в которой равновесие было достигнуто, от низкотемпературной, в которой обозначенные фазовые поля неравновесны и не согласуются с 3 законом термодинамики.
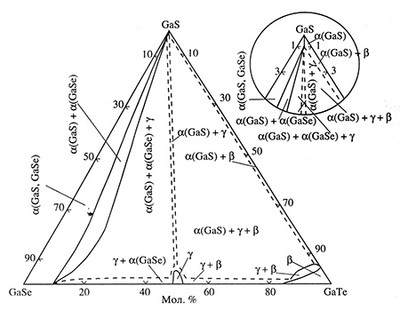
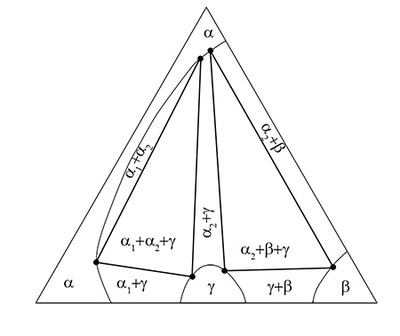
Пример 48. На рисунке 48а представлено изотермическое сечение тройной системы GaS-GaSe-GaTe по данным [74]. Фазовая диаграмма построена неправильно. Схема корректного варианта фазовых равновесий представлена на рис. 48б.
Треугольники, соответствующие трехфазным областям, должны иметь прямые стороны, образованные конодными отрезками. Трехфазные области должны касаться однофазных областей в точках (в соответствии с правилом фаз в соприкасающихся областях).
Пример 49.
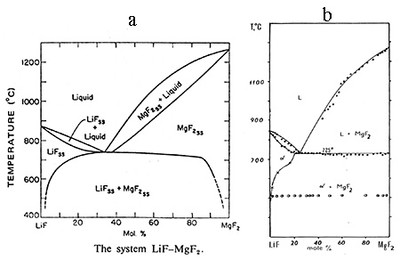
На рис.49а представлена фазовая диаграмма системы LiF-MgF2 по [75].
Рис. 49 (a, b).
По данным американских исследователей - система эвтектического типа, причем образуются обширные области твердых растворов на основе обоих компонентов. Тщательное исследование этой же системы по нашим данным [76] представлено на рис. 49b. Подтверждено существование твердого раствора на основе фторида лития, однако оказалось, что область твердого раствора на основе фторида магния исчезающе мала (эффект эвтектики фиксируется при добавлении уже 1% LiF). Близость температур плавления фторида магния по данным [75] и [76] исключает пирогидролиз как возможную причину расхождений. По-видимому, в работе [75] была применена ошибочная методика расшифровки термограмм (кривые нагревания), связанная с тем, что для температуры ликвидуса пытались засечь "начало эффекта". Заметим, что термические эффекты, отвечающие ликвидусу, не имеют начала. Точнее, их начало совпадает в данном случае с эвтектикой (рис.49с).
Рис. 49c. T-x диаграмма бинарной системы эвтектического типа (а); кривые нагревания некоторых составов (б); неправильное определение температуры ликвидуса для составов 1, 2 (в). Составам 1-4 (а) соответствуют термограммы 1-4 (б). [77]
Пример 50.
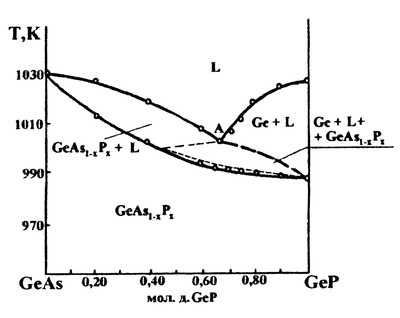
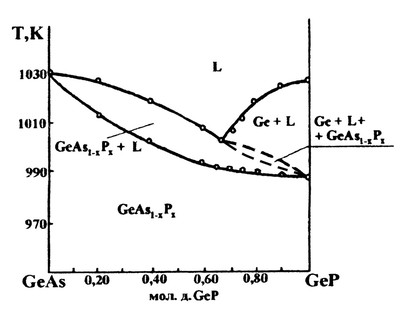
В работе [78] представлена фазовая диаграмма политермического разреза системы Ge-As - Ge-P, характеризующаяся образованием непрерывного твердого раствора между соединениями германия. Авторы правильно сделали вывод о том, что, ввиду инконгруэнтного характера плавления фосфида германия, на фазовой диаграмме должно появляться поле трехфазного равновесия: Ge+L+Ge(As,P) (Рис.50а). Однако они необоснованно придали этой области весьма сложную форму. Нет никаких оснований полагать, что это трехфазное поле касается поля твердого раствора в двух точках. Корректная схема фазовых полей на этом разрезе представлена на рис. 50б.
Рис. 50 (а, б).
Пример 51.
На рисунке 51 представлен политермический разрез тройной системы по данным [79]. Бессвязный набор фазовых областей свидетельствует о неграмотности авторов и некорректности проведенных исследований.
Рис. 51.
Пример 52.
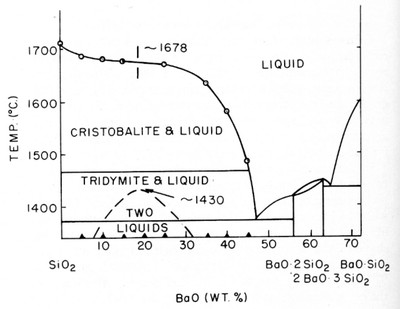
Система SiO2-BaO по [91] приведена на рис.52.
Этот пример аналогичен примерам № 19 и 37. Фаза переменного состава имеет боковое касание в точке с полем расплава.
Рис. 52
Пример 53.
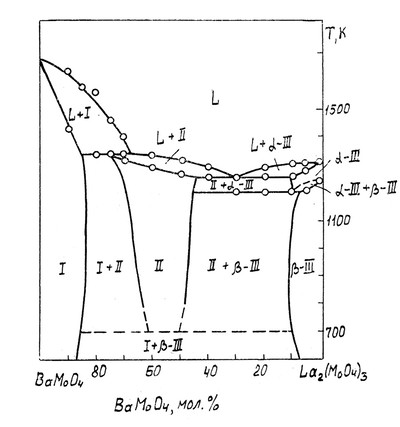
На рисунке представлена диаграмма состояния системы молибдат бария-молибдат лантана по данным Провоторова и др. [92]. Фаза переменного состава II плавится инконгруэнтно и распадается при понижении температуры по эвтектоидной реакции: II = I + beta_III. Ошибка заключается в том, что однофазное поле II соприкасается с трехфазной горизонталью не в точке (как должно быть), а на отрезке.
Рис. 53
Пример 54. (нажмите на рисунок для увеличения)
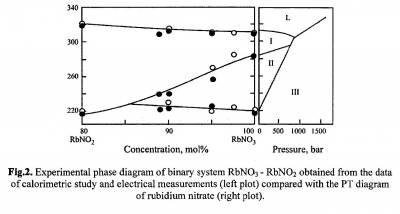
Этот пример полностью аналогичен примеру 16. На рисунке 54, взятом из [98], приведена фазовая диаграмма системы RbNO2-RbNO3. Нитрит рубидия имеет одно полиморфное превращение, нитрат рубидия - два. Справа приведена P-T диаграмма нитрата рубидия. Ошибка заключается в том, что в бинарной системе двухфазные области представлены линиями. Кроме того, на фазовой диаграмме должен присутствовать горизонтальный отрезок, соответствующий равновесию трех твердых фаз. Соблазнительные аналогии между Р-Т и Т-х диаграммами, которые часто проводятся, не являются полными и лимитируются правилом фаз.
Пример 55.
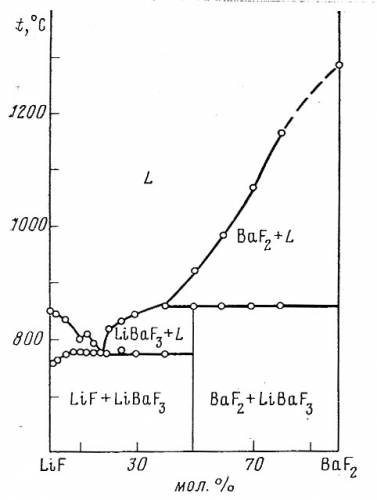
На рис. 55 представлена фазовая диаграмма системы LiF-BaF2 по данным [99]. Во-первых, эвтектика L+LiF+LiBaF3 должна изображаться горизонтальным отрезком как нонвариантное равновесие. Кроме того, кривая ликвидуса LiF изображена немонотонной кривой, имеющей минимум и максимум. Для того, чтобы убедиться, что такой ход ликвидуса невозможен, достаточно поставить фигуративную точку под максимумом и провести коноды до пересечения с полем расплава. Получится 2 жидкости разного состава, что указывает на расслаивание расплава, что в данной системе не реализуется.
Пример 56. На рис. 56, взятом из [101], имеется типичная ошибка (см. примеры № 4, 35). Горизонталь монотектики должна доходить до ординаты компонента.
Пример 57.
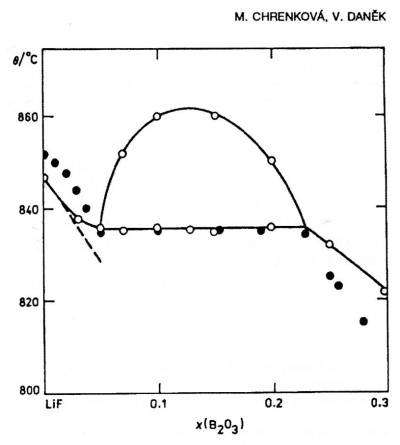
На рис.57а приведена фазовая диаграмма системы хроматов цезия и калия по данным [102]. Компоненты характеризуются наличием полиморфных превращений, причем высоко- и низкотемпературные модификации изоструктурны. В системы образуются непрерывные ряды твердых растворов между высоко- и низкотемпературными модификациями. На фазовой диаграмме правильно представлено поведение кривых плавления (кривые ликвидуса и солидуса сходятся в точке минимума и имеют общую горизонтальную касательную). Однако превращения в твердом состоянии обозначены некорректно. Фазовые переходы первого рода в бинарной системе обязаны проходить через двухфазную область за исключением единичных точек точно так же, как процесс плавления. Корректный вариант фазовой диаграммы представлен на рисунке б.
Пример 58.
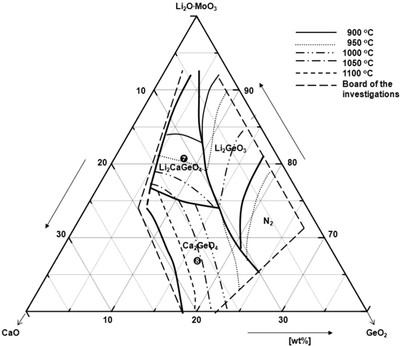
На рисунке 58a приведена фазовая диаграмма из статьи V.A.Ivanov, M.O.Marychev, P.V.Andreev e.a., J.Crystal Growth, 426, 25-32 (2015) [103]. Некорректно проведены изотермы. При изображении проекции поверхностей первичной кристаллизации фаз в тройной системе на концентрационный треугольник, линии изотерм должны пересекаться на линиях совместной кристаллизации. Это необходимое условие нарушено, по крайней мере, для температуры 1000 С. Пример правильного положения изотерм в тройной системе представлен на рис. 58b.
Пример 59.
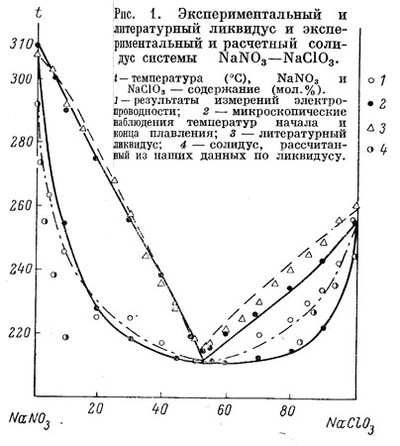
На рисунке 59 представлена фазовая диаграмма системы из нитрата и хлората натрия по [104]. Несмотря на термодинамическую ориентацию работы, на рисунке не выполняются термодинамические требования: 1) точка конгруэнтного плавления твердого раствора не отвечает минимуму на кривых плавления; 2) кривые ликвидуса и солидуса не имеют общей горизонтальной касательной в этой точке (кривая ликвидуса состоит из двух ветвей и, соответственно, имеет недопустимый излом).
Пример 60.
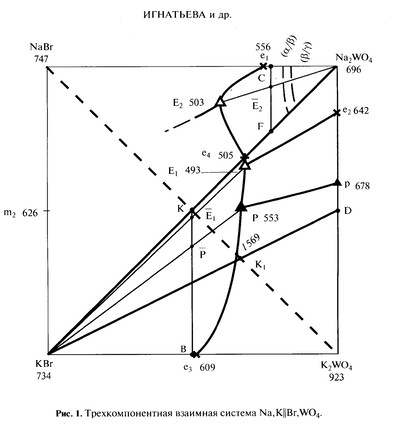
Игнатьева и др., ЖНХ, 2017 [105]
Пример 61.
Пример 62.
6.1. Дополнительные примеры (продолжение)