Ошибки при построении диаграмм
2. Термодинамические правила, которым должны удовлетворять фазовые диаграммы двойных систем
3.1. Характерные ошибки (продолжение)
3.2. Характерные ошибки (продолжение)
5. Разногласия при изучении фазовых диаграмм.
6.1. Дополнительные примеры (продолжение)
Пример 63.
Системы ZrO2-R2O3
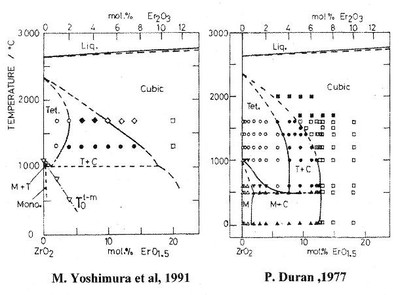
Системы двуокиси циркония с оксидами РЗЭ представляют очень большой интерес для получения кислород проводящих твердых электролитов, фианитов, частично стабилизированной двуокиси циркония. Исследованию фазовых равновесий посвящено очень большое количество работ. Тугоплавкость оксида циркония определяет сложность исследования фазовых равновесий при сравнительно низких температурах. На рисунках а и b представлено 2 варианта фазовых равновесий в системе ZrO2-Er2O3.
Рис. 63а, b
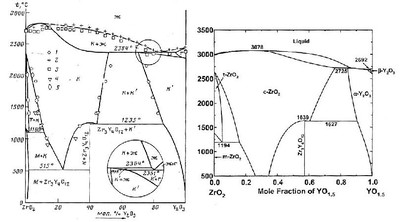
Топологически оба варианта идентичны и не противоречат правилу фаз. Однако в очень тщательной работе французских исследователей [93] зафиксированы завышенные области твердых растворов на основе кубической, тетрагональной и моноклинной модификаций ZrO2. В этой работе продолжительность отжигов линейно увеличивалась с понижением температуры. Этого оказалось совершенно недостаточно для достижения равновесия [94]. В работе японских исследователей [95] показано, что реальные области твердых растворов гораздо уже. При этом продолжительность отжигов (до полугода) достигала, по-видимому, возможного максимума для лабораторных экспериментов. Эти обстоятельства делают невозможным прямое экспериментальное исследование фазовых равновесий при температурах ниже 1000 С. Единственным возможным способом получения информации в этой температурной области является термодинамическое моделирование. На рисунках с и d представлены 2 варианта фазовых равновесий в системе ZrO2-Y2O3, построенные швейцарскими [96] и отечественными [97] исследователями.
Рис. 63с, d
Расчеты, опирающиеся на примерно одинаковые массивы экспериментальных данных, дали достаточно близкие результаты для температур выше 1000 С. Однако на фазовой диаграмме с имеется существенная ошибка: экстраполированная область существования кубической с-ZrO2 фазы переменного состава уходит ниже 0 К. Это противоречит третьему закону термодинамики. Фазовая диаграмма на рисунке d лишена этого недостатка, поэтому более достоверна.
Пример 64.
На рис. 64а приведена фазовая диаграмма состояния системы ПЭВП-ТХБ из тезисов доклада, представленного на конференции "Кинетика и механизм кристаллизации", Иваново, 2014 [100].
На рис. 64б дан корректный вариант диаграммы.
Пример 65.
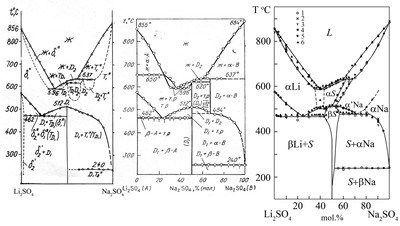
Высокотемпературная часть фазовой диаграммы систем сульфатов лития и натрия в диссертации Акопова построена с грубым нарушением правила фаз. Обозначенный непрерывный твердый раствор между высокотемпературными модификациями компонентов не может существовать, т.к. они не изоструктурны. Предположение существования двух областей расслаивания с нижними критическими точками хотя и весьма экстравагантно, но может объяснить существование горизонталей при 637 и примерно 615 град.С. Однако, горизонталь при 596 С остается без объяснений. В целом вариант фазовой диаграммы является продуктом буйной и ненаучной фантазии автора. Практически одновременно Акопов опубликовал еще один вариант фазовых равновесий в этой системе, также с грубыми нарушениями правила фаз, см. рис.64b. Поскольку на нем появилась горизонталь при 650 С, маркированная "экспериментальными точками", которая отсутствует на предыдущем варианте фазовой диаграммы, можно подозревать автора в мошенничестве. Корректный вариант фазовых равновесий представлен на рис.c.
Рис. 64а - Автореферат дисс. д.х.н. Е.К. Акопова "Теоретическое и экспериментальное исследование взаимных систем на основе хлоридов и сульфатов щелочных металлов и таллия", Ростов-на-Дону, 1968.
Рис. 64b -Акопов. Термографический и рентгенофазовый анализы системы Li2SO4-Na2SO4. ЖНХ, 1968, т.13(7), С. 1941
Рис. 64c - Fedorov P.P., Proydakova V.Yu., Kuznetsov S.V., Voronov V.V., Pynenkov A.A., Nishchev K.N. Phase diagram of the Li2SO4-Na2SO4 system // J. Amer. Ceram. Soc. 2020. V. 103(5). P. 3390-3400. https://doi.org/10.1111/jace.16996