3.2. Характерные ошибки (продолжение)
Пример 24. На рис. 24а представлена фазовая диаграмма системы из фторидов свинца и иттрия по [42], согласно которой между компонентами при кристаллизации из расплава образуется непрерывный твердый раствор. Аномальной является уже форма кривых ликвидуса и солидуса с горизонтальными участками, не смыкающимися между собой. Система построена неверно. Это следует из того, что компоненты имеют различные кристаллические структуры (высокотемпературная модификация PbF2 кубическая, типа флюорита, пространственная группа Fm3m, низкотемпературная - ромбическая, типа хлорида свинца, пр. группа Pnmb; высокотемпературная модификация фторида иттрия гексагональная, типа альфа-UO3, низкотемпературная - ромбическая, типа цементита, пр. группа Pnma) и, соответственно, не могут образовывать между собой непрерывные твердые растворы. Корректная фазовая диаграмма этой системы, по данным [43], представлена на рис. 24b. В этой системе обнаружены ограниченные твердые растворы на основе флюоритовой модификации фторида свинца с максимумом на кривой плавления (полиморфный переход фторида свинца имеет место при 350°С и не отражен на диаграмме состояния) и три промежуточные фазы.
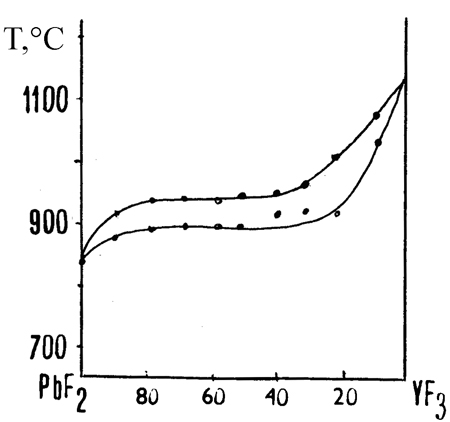
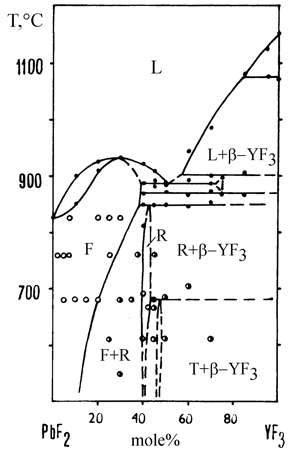
Рис. 24. Т-х фазовая диаграмма системы PbF2 – YF3 по данным [42] (а) и [43] (b). Точки – данные ДТА, белые кружки – однофазные образцы, получерные кружки – двухфазные образцы по данным рентгенофазового анализа.
Пример 25. По данным [44], представленным на рис. 25а, кривая ликвидуса системы фторид кальция - фторид лантана имеет четыре максимума, которые приписаны четырем промежуточным соединениям с отношением компонентов 20:1, 4:1, 1:1 и 1:2. Рентгенографически образование соединений не было подтверждено. В действительности эта система - эвтектического типа с ограниченными твердыми растворами на основе компонентов ([45], см. рис. 25b). Ошибочные результаты [44], по-видимому, объясняются термографированием неравновесных образцов.
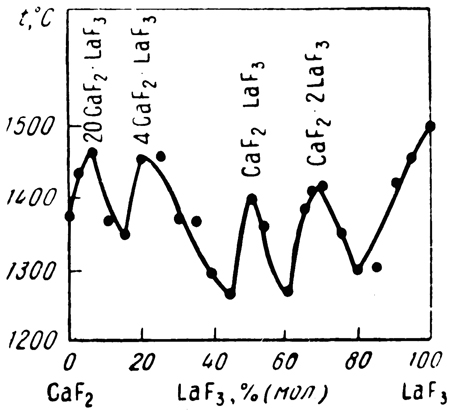
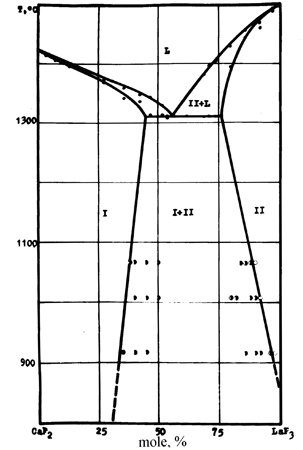
Рис. 25. Т-х фазовые диаграммы системы CaF2 – LaF3 по данным [44] (а) и [45] (b).
Обозначение фаз: I – твердый раствор
Ca1-xLaxF2+x , II - твердый раствор La1-yCayF3-y
Пример 26. На рис. 26 приведен изотермический разрез тройной системы La2O3 - Sm2O3 - Yb2O3 по данным [46]. А, В, С, Р - фазы переменного состава различной кристаллической структуры. Построенный разрез удовлетворяет правилу фаз в соприкасающихся областях. Топология его не вызывает возражений. Однако, представленный разрез построен некорректно. Через каждую точку, находящуюся в двухфазной области изотермического сечения тройной системы, должна проходить прямолинейная конода, связывающая точки, отвечающие составам фаз, находящихся в равновесии. Таким образом, двухфазные области на изотермических сечениях тройных систем должны быть ограничены с двух сторон отрезками прямых линий, а трехфазные области - представлять собой треугольники с прямолинейными сторонами. Эти условия на выполняются для сечения, изображенного на рис. 26. Экспериментальные точки, представленные на рис. 26, не позволяют в некоторых случаях провести прямолинейные границы трехфазных областей. Причинами этого может быть недостижение равновесия в результате отжига, неполная закаливаемость фазовых равновесий, а также трудности определения методом рентгенофазового анализа числа фаз, присутствующих в образце, если их рентгенограммы близки между собой.
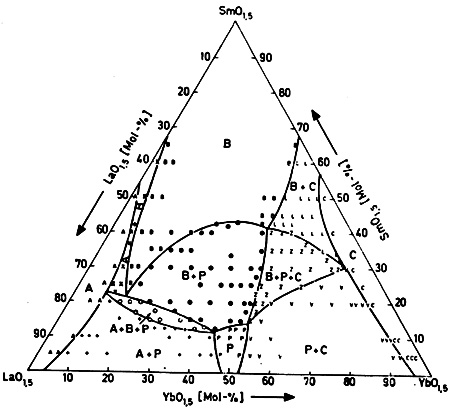
Рис. 26. Фазовые поля в системе La2O3 - Sm2O3 - Yb2O3 при 1400 °С по данным [46].
Пример 27. На рис. 27 представлены результаты изучения фазообразования в системе оксид лантана - оксид железа (Ш) - гидроксид калия - вода методом гидротермального синтеза [47]. Полученная диаграмма не согласуется с правилом фаз в соприкасающихся областях состояния. Область, отвечающая кристаллизации одной кристаллической фазы (феррита лантана LaFeO3), может граничить с областью сосуществования трех твердых фаз только в точке, но не по линии. На диаграмме не хватает области LaFeO3 + La(OH)3 или LaFeO3 + альфа-Fe2O3. Подобные упущения типичны в работах по гидротермальному синтезу.
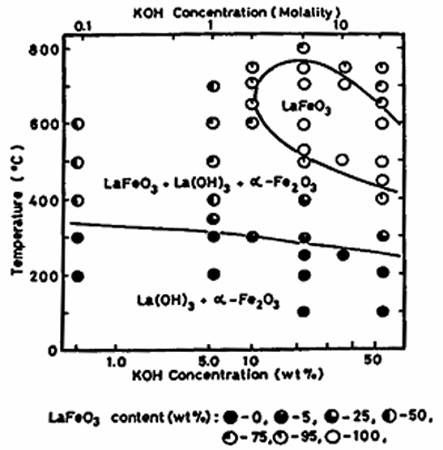
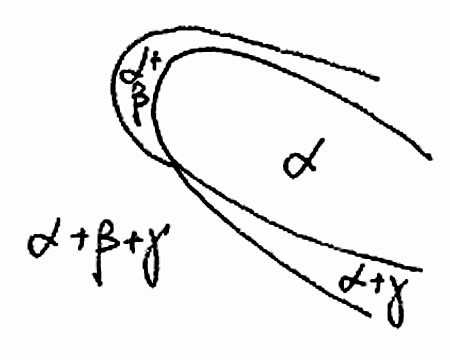
Рис. 27. Фазовые равновесия в системе La2O3-Fe2O3-KOH-H2O при 100 МПа по [47] (a) и возможная корректная схема фазовых равновесий с участием трех фаз (b).
Пример 28. Данный пример (рис. 28) аналогичен предыдущему. Поля кристаллизации фаз, намеченные в результате изучения образцов методом гидротермального синтеза [48], не удовлетворяют правилу фаз в соприкасающихся областях. Между фазовыми полями I+IV и I+III должно находиться поле I+III+IV, а между фазовыми полями I+V и I+II - поле I+II+V, пропущенные при исследовании. Поле I и поле I+II+III могут контачить только в точке.
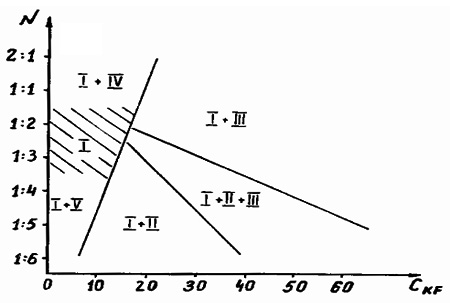
Рис. 28. Поля кристаллизации фаз в системе Ho2O3-GeO2-KF-H2O, выявленные методами гидротермального синтеза [48]. N – мольное отношение Ho2O3/GeO2,С – вес.% KF. Обозначение фаз: I - Ho2Ge2O7, II- K2Ge4O9, III - K2HoF5, IV – Ho(OH)3, V - GeO2.
